Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken (metal, grafit, veya yarı iletken) ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.
Elektrokimyasal reaksiyonlar, kimyasal enerjinin elektrik enerjisine veya elektrik enerjisinin kimyasal enerjiye dönüştürüldüğü reaksiyonlardır. Elektrokimyasal reaksiyonlar, genellikle bir pil veya elektroliz hücresi gibi bir elektrokimyasal hücrede gerçekleşir.
Piller, kimyasal enerjiyi elektrik enerjisine dönüştüren cihazlardır. Piller, günlük hayatımızda birçok alanda kullanılır. Örneğin, cep telefonları, televizyonlar ve bilgisayarlar pillerle çalışır.
Elektroliz hücreleri, elektrik enerjisini kimyasal enerjiye dönüştüren cihazlardır. Elektroliz hücreleri, sanayide birçok alanda kullanılır. Örneğin, metallerin ayrıştırılması, plastiklerin üretilmesi ve suyun arıtılması elektroliz hücreleri kullanılarak yapılır.
Elektrokimyanın bazı temel kavramları şunlardır:
- Elektrot: Elektronların aktarıldığı yüzeydir.
- Elektroliz: Elektrik akımının bir kimyasal reaksiyona yol açmasıdır.
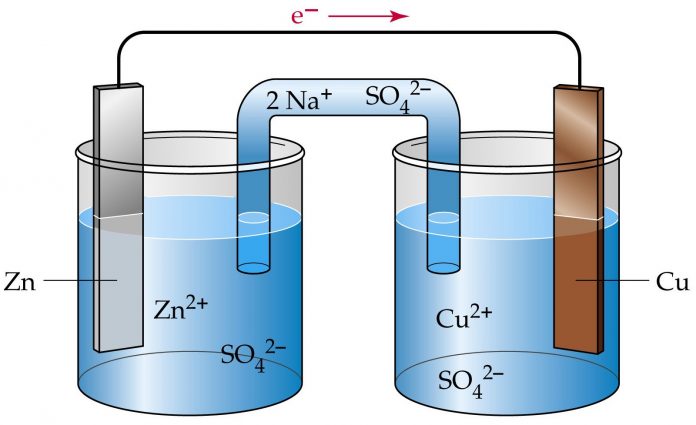
- Galvanik hücre: Kimyasal enerjiyi elektrik enerjisine dönüştüren bir hücredir.
- Elektromotor kuvvet (emk): Bir elektrokimyasal hücrede, reaksiyonun gerçekleşmesi için gerekli olan potansiyel farktır.
- Potansiyel fark: İki nokta arasındaki elektriksel potansiyel farkıdır.
- Redoks reaksiyonu: Elektron transferi ile gerçekleşen bir kimyasal reaksiyondur.
Elektrokimya, kimya, biyoloji ve mühendislik gibi birçok alanda önemli bir rol oynar.